КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ СУПРАМОЛЕКУЛЯРНОЙ СИСТЕМЫ,
СОСТОЯЩЕЙ ИЗ МОЛЕКУЛ ФЛУОРЕСЦЕНТНЫХ КРАСИТЕЛЕЙ, ЛИПИДОВ И ВОДЫ
С. Зайцев, М. Шапошников, Д. Соловьева, М. Бартов*, П. Волынский*
Московская
государственная Академия ветеринарной медицины и биотехнологии имени К.И. Скрябина, Москва, Россия.
* Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия.
s.y.zaitsev@mail.rumihan2404@mail.rud.solovieva@mail.ru_ariman_@list.ru
Оглавление
Аннотация
Проведено
моделирование процесса взаимодействия новых производных родаминов - фотоактивируемых флуоресцентных красителей (ФФК) и
липидного бислоя - аналога природных мембран на
основе 1- пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолина (ПОФХ)
с помощью метода молекулярной динамики с использованием средств визуального
анализа полученных результатов. Супрамолекулярная
система содержала 2 молекулы ФФК, помещенные в воду по разные стороны бислоя (сверху и снизу от него), 128 молекул ПОФХ и 5258
молекул воды. Активное связывание ФФК с ПОФХ начиналось уже через 350 пс, причем обе молекулы ФФК стремились расположиться ближе
к центру бислоя. В ходе изучения параметров
взаимодействия ФФК с ПОФХ была рассчитана радиальная функция распределения молекул
красителя относительно воды. Выявленные особенности поведения ФФК при движении
сквозь липидную мембрану важны для разработки методик окрашивания такими
красителями клеток и препаратов органов и тканей в медицине человека и
животных.
Ключевые слова: компьютерное моделирование, визуальный анализ, молекулярная
динамика, флуоресцентные красители, липидный бислой,
мембрана.
Одним из перспективных и
активно развиваемых направлений современной физико-химической биохимии и бионанотехнологии является разработка и применение фотоактивируемых флуоресцентных красителей (ФФК),
обладающих селективными свойствами окрашивания тканей, клеток и субклеточных
органелл [1, 2]. Актуальным подходом к решению указанных задач является
введение в молекулы родаминов тиоамидных и N–нитрозотиоамидных
групп, что дает возможность синтезировать ФФК вначале в так называемой
«закрытой» (или «cпиросочлененной»)
бесцветной форме и способствует повышению их мембранной проницаемости.
Облучение светом с λ ≥ 375 нм вызывает раскрытие пятичленного цикла
и регенерирует «открытую» (окрашенную) флуоресцентную форму. Изменяя мощность и
локализацию облучающего света можно варьировать число и пространственное
расположение образовавшихся флуоресцентных «зондов», следить за их движением,
определять форму и взаимное расположение клеточных и субклеточных объектов,
помеченных этими красителями [3-5]. Показано, что способность окрашивания
клеточных органелл присутствует в разной степени у всех родаминовых
красителей, при этом эффективность окрашивания зависит от способа их доставки в
клетку (используемого растворителя) [6]. Это позволяет предположить, что
основным механизмом проникновения красителей в клетку является свободная
диффузия, облегченная воздействием используемых растворителей. В этом случае,
важным аспектом прохождения через мембрану является взаимодействие «ФФК-липидный бислой», поскольку
липидная составляющая имеет большое значение при свободной диффузии
низкомолекулярных соединений через мембрану. Причина отличий в активностях
исследуемых красителей при использовании одинаковых растворителей может
заключаться в различной эффективности диффузии через мембрану, что в свою
очередь может быть обусловлено отличиями взаимодействий «ФФК-мембрана» на
атомном уровне. Таким образом, исследование взаимодействий «ФФК-липидный
бислой» является важным этапом для понимания диффузии
молекул красителя через мембрану.
Для правильного и
высокоэффективного использования указанных систем и процессов требуется
построение и компьютерное моделирование супрамолекулярной
системы, состоящей из нескольких молекул ФФК, помещенные в воду по разные
стороны бислоя, сотни молекул липида 1-
пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолина (ПОФХ) и тысячи молекул
воды. Взаимодействия в такой системе и между всеми компонентами резонно
моделировать с помощью метода молекулярной динамики (МД).
Целью
работы являлось компьютерное
моделирование взаимодействия ФФК-814 с модельным липидным бислоем
ПОФХ методом молекулярной динамики с использованием средств визуализации получаемых
результатов.
Новые ФФК были синтезированы
под руководством В.Н. Белова в Макс-Планк-Институте биофизической химии (г. Гёттинген, ФРГ). Детали синтеза и свойства ФФК-814
опубликованы в работе [2], а их химическая структура приведена на рис. 1.
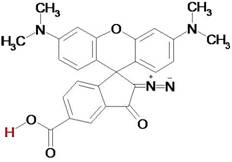
Рис. 1. Химическая структура ФФК-814.
На первом этапе c помощью
программы Maestro (Schrödinger)
были созданы молекулярные топологии красителей ФФК-813 и ФФК-814. Корректность
топологий проверяли в расчетах МД в вакууме и в воде в течение 10 нс.
В качестве
модели биологической мембраны был использован предварительно уравновешенный
бислой ПОФХ (128 молекул). Топология липида была взята из базы данных веб-сайта
http://moose.bio.ucalgary.ca.
Расчеты МД проводились в
программном пакете GROMACS 4.0 [7,8] со стандартным силовым полем GROMOS96
[9], специально адаптированном для липидов. Уточнение зарядов атомов проведено с
помощью программы для квантово-химических расчетов Gaussian 03W [10] в базисе HF/6 –
Моделирование взаимодействия
красителей с мембраной проводили следующим образом:
(1) молекулы красителя
встраивали в ячейку с уравновешенным бислоем на разную глубину;
(2) удаляли из системы
молекулы воды и/или липидов, перекрывающиеся с красителем;
(3) уравновешивали систему в
течении 100 пс МД с нагреванием от 5 до 300 К;
(4) проводили расчет МД
длительностью 10 нс.
Все расчеты МД проводили при
постоянной температуре (300 К) и давлении (1 бар) которые поддерживали с
использованием термостата и баростата Берендсена.
Моделирование проводили с использованием периодических граничных условий. Шаг
интегрирования 2 фс. Для учета дальнодействующих невалентных взаимодействий использовали метод двойной
отсечки (10/12 Å). Длительность каждого расчета составляла 10 нс. Всего
для каждого красителя было проведено по 5 расчетов МД с различным стартовым
положением относительно бислоя (d = 10, 0, -5, -10, -15 Å, где d -
расстояние от центра красителя до положения фосфатов). При моделировании из
воды (d = 10 Å) и с интерфейса мембраны (d = 0 Å) для увеличения
статистики к системе добавляли по две молекулы красителя с разных сторон
бислоя.
Для анализа
взаимодействия красителей и фосфолипидов были получены и визуально
проанализированы данные по изменению положения красителя относительно бислоя во
времени и радиальной функции распределения молекул красителя относительно воды.
Для оценки связывания
красителей с бислоем ПОФХ, проведено моделирование их
встраивания со стартовым положением в воде (Рис. 2). Начальное расположение
молекул одинаковое, оно изображено на рис. 2а. Конечные положения динамики
встраивания для ФФК-814 показано на рис. 2б.
 а
а 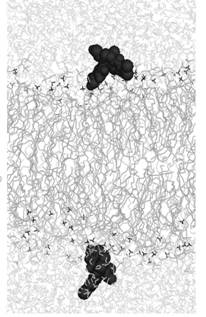 б
б
Рис. 2. Моделирование встраивания со стартовым положением
красителя в
воде (а – стартовое положение молекул, б - конечное
положение ФФК-814).
Ассоциация
молекул ФФК с мембраной произошла за первые 350 пс
расчета (расстояние до интерфейса d уменьшилось до 2 Å и в дальнейшем не
увеличивалось). Данные визуального анализа указывают на существование
определенной моды взаимодействия ФФК-814 с бислоем
ПОФХ. При этом одно из гидрофобных колец погружено в гидрофобную область
мембраны, а полярная –COOСН3 группа взаимодействует с полярной
областью мембраны и водой. Это состояние наблюдалось для одной из молекул
красителя на протяжении более чем половины времени МД. Однако на данном этапе в
ходе МД не наблюдалось проникновения молекулы красителя вглубь мембраны, он
оставался связанным с ее поверхностью. Это позволяет предположить наличие
некого энергетического барьера, препятствующего движению красителя. Для
дальнейшего изучения поведения красителя его встраивали на разную глубину
мембраны.
Было проведено встраивание
молекул исследуемого красителя на разную глубину гидрофобной области
фосфолипидного бислоя. В случае МД со стартовым расположением красителей в
неполярной области бислоя (d
< – 5 Å) наблюдалась общая тенденция – ФФК дрейфовал в
области ацильных цепей мембраны и наиболее часто
располагался в центре бислоя – в области пониженной плотности мембраны.
В случае старта из области
интерфейса мембрана-вода динамическое поведение красителя зависело от его
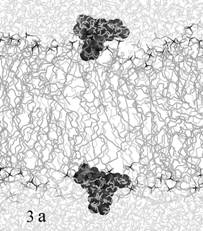
стартовой ориентации относительно мембраны. На рис. 3а изображено одинаковое
для обеих молекул красителя стартовое положение на интерфейсе мембраны, на рис.
3б – промежуточное положение ФФК-814 в динамике.
 а
а 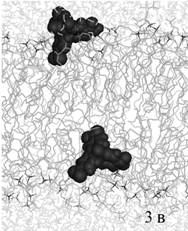 б
б
Рис. 3. Моделирование встраивания со стартовым положением
красителя на поверхности бислоя
(а – стартовое положение красителей, б - промежуточное
положение ФФК-814).
Видно, что
«нижние» молекулы прошли полярную область мембраны и проникли в липидный бислой на уровне нижнего монослоя. Следует отметить, что для этих молекул в
стартовом состоянии полярная –COOН группа была
ориентирована внутрь мембраны и, следовательно, частично десольватирована.
В случае сольватированной –COOН
группы («верхние» молекулы) такого встраивания в мембрану не наблюдается. Это
позволяет предположить, что основную роль в создании барьера играет сольватация- десольватация функциональных
групп ФФК.
Анализ радиальных функций распределения молекул воды относительно –COOН групп показал, что в случае ФФК-814 сольватация
больше, чем для исходного родаминового красителя. Таким образом, для ФФК-814 можно
предположить менее высокую скорость проникновения через мембрану, чем для
других родаминовых красителей.
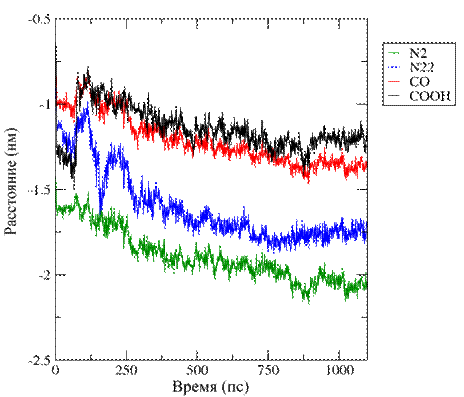 а
а
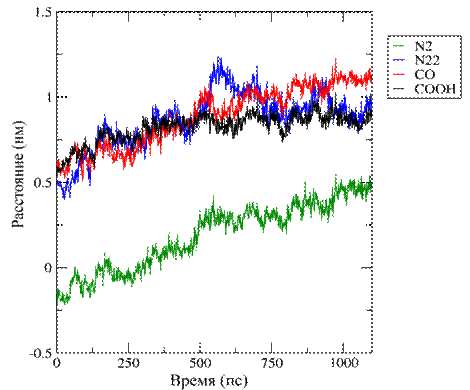 б
б
Рис. 4. Изображение изменения положения функциональных
групп ФФК-814
в пространстве: (а) Глубина 1,5±0,2 нм, (б) Глубина 2,7±0,1 нм.
На рисунке 4 представлено изменение положения
функциональных групп в пространстве для ФФК-814 относительно
фосфорной группы липида в бислое. Сдвиг
в отрицательную область обусловлен изменением расстояния до референтной
фосфорной группы при встраивании ФФК-814 в верхний монослой,
сдвиг в положительную область - при встраивании ФФК-814 в нижний монослой.
Указанные выше данные рис. 2-4, подтверждают
стремление молекул красителя ФФК-814 расположиться ближе к центру липидного бислоя.
Впервые
построены и описаны молекулярные топологии исследуемого красителя ФФК-814.
Качественно с использованием визуального анализа охарактеризованы параметры
взаимодействия ФФК-814 с липидным бислоем ПОФХ
методом молекулярной
динамики.
Авторы выражают искреннюю благодарность В.Н. Белову (Макс-Планк-Институт биофизической химии, г. Гёттинген, ФРГ) за синтез образцов ФФК и д.ф.-м.н. Ефремову Р.Г. (ИБХ РАН) за ценный вклад в обсуждение данной работы.
1. Hell S.W. Far-Field Optical Nanoscopy. //
Science. 2007. V. 316. P. 1153–1158.
2. Boyarskiy V.P., Belov
V.N., Medda R., Hein B., Bossi
M., Hell S.W. Photostable, Amino reactive and
water-soluble fluorescent labels based on sulfonated rhodamine with a rigidized xanthene fragment // Chem. Eur. J. 2008. V. 14. P. 1784 –
1792.
3. Molho J.I., Herr A.E., Mosier B.P.,
Santiago J.G., Kenny T.W., Brennen R.A., Gordon G., Mohammadi B. Optimization of Turn Geometries for Microchip
Electrophoresis // Anal. Chem. 2001. V. 73. P.
1350–1360.
4. Paul P.H., Garguilo M.G., Rakestraw D.J. Imaging of Pressure- and Electrokinetically
Driven Flows through Open Capillaries // Anal. Chem. 1998.
V. 70. P. 2459–2467.
5. Willis R.C. Portraits of Life: One Molecule at a Time. // Anal. Chem., 2007. V. 79. P.
1785–1788.
6. Коваленко Г.В., Коваленко
И.Ф., Линник Т.П. Механизм транспорта ДМСО, глицерина
и этиленгликоля через мембраны эритроцитов крысы и кролика // Вестник
Харьковского государственного университета им. В.Н. Каразина,
2009, вып.10, №878, с. 109-116.
7. Spoel D., van Buuren
A.R., Berendsen H.J. et all. Gromacs
User Manual, ftp://ftp.gromacs.org-/pub/manual/manual-3.3.pdf, version 3.3.
8. Spoel D, Lindahl
E, Hess B, Groenhof G, Mark A.E. and Berendsen H.J. GROMACS: fast, flexible, and free // J. Comput. Chem., 2005. V. 26. P.
1701-1718.
9. Schuler L.D., Van Gunsteren W.F. On the
Choice of Dihedral Angle Potential Energy Functions for n-Alkanes
// Molecular Simulation, 2000, V. 25. P. 301-319.
10. Shubin Liu, Ph.D.
Introduction to Gaussian and GaussView, Research
Computing, ITS, 2005.
COMPUTER MODELING OF THE
SUPRAMOLECULAR SYSTEM
CONSISTING OF FLUORESCENT DYE, LIPID AND WATER MOLECULES
S. Zaitsev, M. Shaposhnikov,
D. Solovyeva, M. Bartov*,
P. Volynskii*
Moscow State Academy of Veterinary Medicine and Biotechnology named after K.I. Skryabin, Moscow, Russia.
* Shemyakin-Ovchinnikov Institute of
Bioorganic Chemistry, RAS, Moscow, Russia.
s.y.zaitsev@mail.rumihan2404@mail.rud.solovieva@mail.ru_ariman_@list.ru
Abstract
The modeling of interaction process between the new rhodamine
derivatives - photoactive fluorescent dye (PFD) with lipid bilayer
– analog of native membrane based on
palmitoyl-2-oleoyl-sn-glycero-3-phosphatidylcholine (POPC) is studied by the
molecular dynamic method with the visualization analysis tools of the obtained
results. The supramolecular system
containing two PFD molecules (situated on the both sides of the bilayer), 128 POPC and 5258 water molecules. Active
binding PFD with POPC begins at about 350 ps and both
PFD molecules gravitate to the bilayer center. During
the study of the interaction parameters PFD with POPC the radial function of
these dye molecules distribution against water has been calculated. The
specific features of the dye’s behavior during their movement through the lipid
membrane are revealed that is important for cell samples staining in human and
animal medicine.
Key words: computer modeling, visualization analysis, molecular dynamics,
fluorescent dyes, lipid bilayer, membrane.
Reference
1. Hell S.W. Far-Field Optical Nanoscopy. Science. 2007. V. 316. P. 1153–1158.
2. Boyarskiy V.P., Belov
V.N., Medda R., Hein B., Bossi
M., Hell S.W. Photostable. Amino reactive and
water-soluble fluorescent labels based on sulfonated rhodamine with a rigidized xanthene fragment. Chem. Eur. J. 2008. V. 14. P. 1784 –
1792.
3. Molho J.I., Herr A.E.,
Mosier B.P., Santiago J.G., Kenny T.W., Brennen R.A.,
Gordon G., Mohammadi B. Optimization of Turn
Geometries for Microchip Electrophoresis. Anal. Chem. 2001. V. 73. P.
1350–1360.
4. Paul P.H., Garguilo M.G., Rakestraw D.J. Imaging of Pressure- and Electrokinetically
Driven Flows through Open Capillaries. Anal. Chem. 1998. V. 70. P. 2459–2467.
5. Willis R.C. Portraits of Life: One Molecule at a Time. Anal. Chem., 2007. V. 79. P.
1785–1788.
6. G.V. Kovalenko, I.F. Kovalenko,
T.P. Linnik. The mechanism of DMSO,
glycerol and ethylene glycol transport across rat and rabbit erythrocyte
membranes. The journal of V.N.Karazin
Kharkov National University, 2009, v.10, №878, pp. 109-116.
7. Spoel D., van Buuren
A.R., Berendsen H.J. et all.
Gromacs User Manual, version 3.3. Available at:
ftp://ftp.gromacs.org-/pub/manual/manual-3.3.pdf
8. Spoel D, Lindahl
E, Hess B, Groenhof G, Mark A.E. and Berendsen H.J. GROMACS: fast, flexible, and free. J. Comput. Chem., 2005. V. 26. P.
1701-1718.
9. Schuler L.D., Van Gunsteren W.F. On the
Choice of Dihedral Angle Potential Energy Functions for n-Alkanes.
Molecular Simulation, 2000, V. 25. P. 301-319.
10. Shubin Liu, Ph.D.
Introduction to Gaussian and GaussView, Research
Computing, ITS, 2005.